男性勃起功能障碍是指男性持续性或反复发作的难以达到和维持阴茎勃起来完成性交和满意的性活动的病理现象。阴茎的勃起依赖于一系列正常的神经和血管性反应,包括正常的性心理反应,正常的生理结构,正常的内分泌,神经和血管功能。任何一个环节的异常必将导致勃起功能障碍。自1998年万艾可的问世以来,男性勃起功能障碍领域取得了突飞猛进的发展,尤其是在基础研究领域。
一、流行病学研究进展
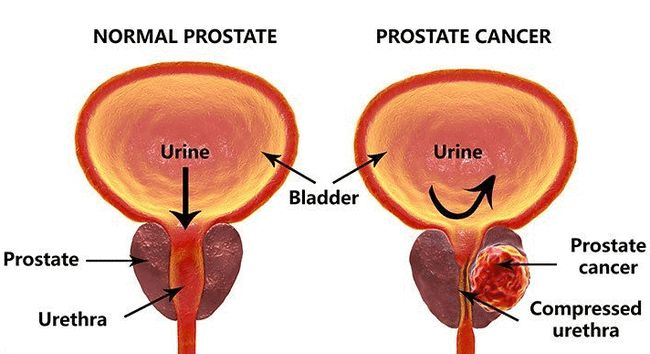
(一)前列腺癌与男性勃起功能障碍
前列腺癌作为男性常见的恶性肿瘤,对男性性功能有着显著的影响。勃起功能障碍是最常见的治疗后并发症"。在介入性最小的观察性治疗中,约有45%的病人患有不同程度的勃起功能障碍,而放射性治疗可导致34%~62%的勃起功能障碍。前列腺癌根治术后,85%的病人患有不同程度的勃起功能障碍"。而在另一项临床试验中发现,虽然59.9%病人在术后18个月有不同程度的阴茎勃起,仅有22%的病人在24个月时恢复可以完成性交的勃起,即使在术后60个月,也仅有28%病人的重新恢复正常的性功能。
目前认为,神经血管性损害是前列腺癌导致男性勃起功能障碍的主要机理。首先,阴茎勃起神经的损伤可引起阴茎海绵体平滑肌细胞,尤其是白膜下阴茎海绵体平滑肌细胞的凋亡,导致海绵体功能不良:其次是海绵体内胶原成分的显著增加,临床病理活检和动物实验均发现在双侧阴茎勃起神经损伤时,TGF-B和胶原I/Ш的表达显著增加。另外,静脉漏亦是前列腺癌根治术后的另一项病理改变。
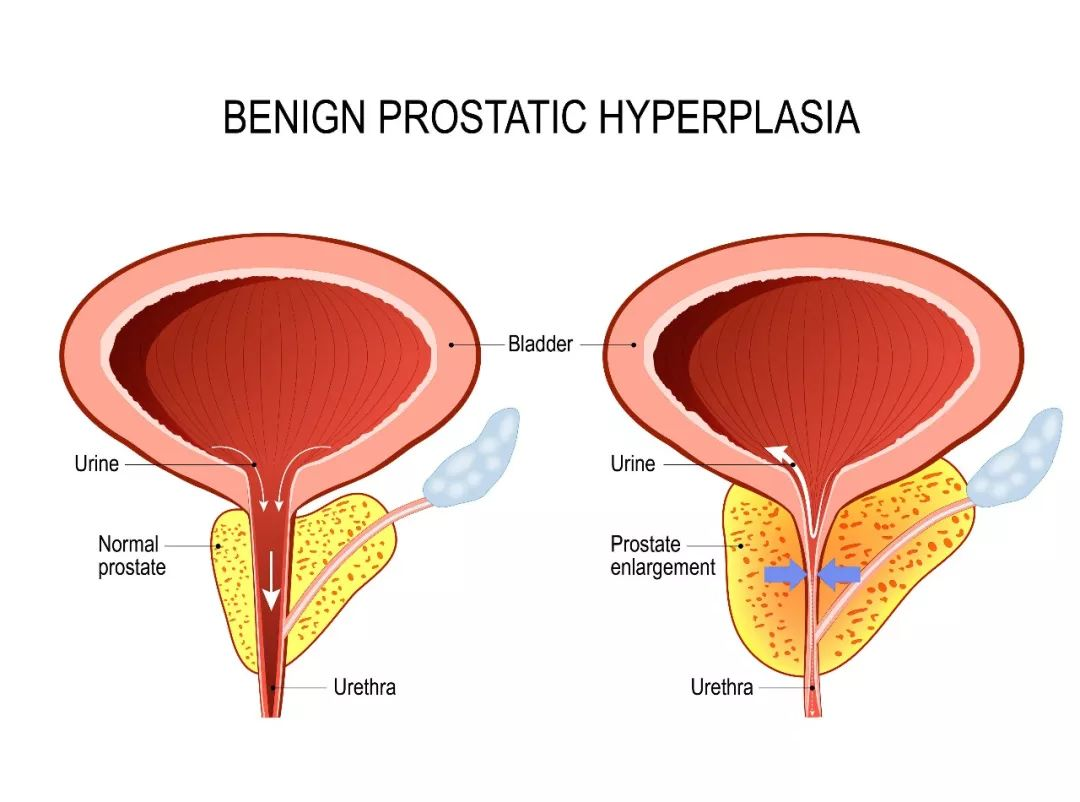
(二)下尿路综合征(LUTS)和前列腺良性增生(BPH)症与男性勃起功能障碍
近10年来,越来越多的流行病学研究证明了下尿路综合征(LUTS)和前列腺良性增生症(BPH)与男性勃起功能障碍有密切关系"。在美国和欧洲完成的一项关于12815例老年病人的调查(MSAM-7)表明49%的LUTS病人患有勃起功能障碍。澳大利亚的调查发现,84%的20~80岁的男性患有不同程度的LUTS,其中32%的患有勃起功能障碍。日本亦有类似的报道。
虽然具体的分子生物学机理并不清楚,几类可能的下尿路综合征(LUTS)和前列腺良性增生(BPH)导致男性勃起功能障碍原理已经被提出。包括交感性神经活性和自发活动的增加:调控阴茎海绵体平滑肌细胞收缩信号通路RhoA/ROCK的改变:以一氧化氮合成酶/一氧化氮释放障碍为表现的内皮功能不全:动脉硬化导致的盆腔缺血:以及老年性激素失调等。以上诸多因素最终导致阴茎海绵体平滑肌细胞萎缩和海绵体内胶原成分的增加。
(三)糖尿病与男性勃起功能障碍
WHO的报告指出,目前世界上约有15亿病人患有不同程度的糖尿病,并预计在2025年将会增加1倍。I型和I型糖尿病病人患勃起功能障碍的可能性是正常人的3倍。研究表明,50%~75%的糖尿病病人患有不同程度的勃起功能障碍。
大量动物实验和临床病理活检表明,多因素机制是糖尿病导致勃起功能障碍的主要机理。糖尿病病人阴茎海绵体平滑肌细胞松弛能力的减低与NO生物活性的低下有关,这主要是阴茎海绵体内皮细胞中eNOS表达降低,eNOS活性减弱,eNOS蛋白Ser-1177磷酸化的减少等所致。最新的研究发现,HSP90是eNOS的主要活化因子,而高血糖可影响eNOS与HSP90的正常相互作用:另一方面,caveolin-1则通过与eNOS竞争其钙调蛋白结合位点而抑制eNOS的酶活性,实验发现,糖尿病时caveolin-1的表达显著增加。其次,阴茎海绵体内皮细胞的损伤亦导致了NO非依赖性内皮松弛因子的减少,包括内皮源性多极因子(EDHF)和前列环素(prostacyclin)等。
近年来,一条调控阴茎海绵体平滑肌收缩的信号通路RhoA/ROCK引起了广泛关注。大量的体外和动物实验研究发现,高血糖及糖尿病可导致RhoA和ROCKI/II表达及活性的提高,从而使阴茎海绵体平滑肌难以松弛并完成正常勃起。

(四)阴茎硬结症与男性勃起功能障碍
阴茎硬结症在男性的发病率为0.38%~23%不等Lindsay调查了19~83岁的男性,阴茎硬结症的发病率为0.38%,而LaPera等发现在50~69岁男性中发病率高达7.1%。虽然阴茎硬结症并不常见,但男性勃起功能障碍在此类病人中具有非常高的发生率。Jarow和Lowe报告80%的阴茎硬结症患者为勃起功能障碍,而Jordan和Angermerier则发现几乎100%的阴茎硬结症病人患有勃起功能障碍。
目前,有关的具体机理并不清楚。可能的原理包括阴茎白膜硬结斑块形成过程中一些特殊部位形成的静脉漏,血管性因素,阴茎硬结症继发的心理性因素等。我们的研究发现,阴茎硬结症时TGF/SMAD信号通路的高度活化是勃起功能障碍形成的一个重要分子生物学机制。
(五)心血管疾病与男性勃起功能障碍
心血管疾病,尤其是冠心病与男性勃起功能障碍有密切关系,它们具有相同的高发因素,包括糖尿病、高血压、高脂血症、肥胖和嗜烟等。Montoris等调查了700例冠心病人,发现42%~57%患有男性勃起功能障碍:而在隐性冠心病人中,勃起功能障碍的发生率亦高达33.8%。在另一面,勃起功能障碍又是许多心血管疾病的预警指标。研究表明,100%的I型糖尿病人在发生冠心病之前已患有男性勃起功能障碍,而且多在33.8个月之前"。
正常的血管内皮细胞产生许多血管疏缩因子,包括NO,前列腺素尤其是前列环素和TXA2等。心血管疾病导致男性勃起功能障碍的主要机制是血管内皮细胞功能损伤。
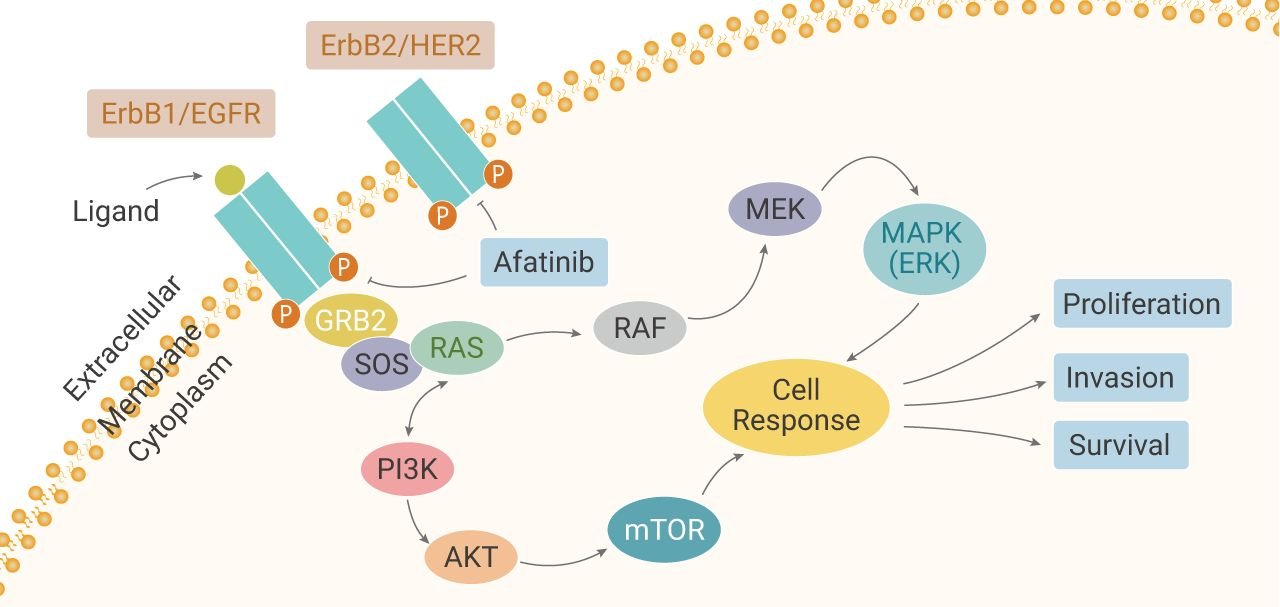
二、PDEs及其抑制剂的研究进展
(一)PDEs亚型活性的研究
PDE是细胞内调控第二信使cAMP和cGMP细胞内浓度的关键活性酶,人类基因编码了21个PDEs基因并被分为12个家族,目前发现共有60余个PDE酶亚型分布于全身各个脏器组织。其中PDEs是分布于阴茎最主要的功能亚型,调控阴茎的勃起与松弛。
PDEs共有3个亚型,包括PDESA1,PDE5A2和PDE5A3。研究表明,PDE5A2是人类阴茎中的功能酶,但对PDEsA:和PDEsA3的功能及其意义了解甚少。我们"克隆了PDEs3个亚型的全长cDNA,并构建了其杵状病毒表达系统在蝴蝶昆虫表达细胞中表达纯化了PDESA1,PDEsA2和PDE5A33个活性酶。通过两步法酶活性研究发现,它们的cGMP水解活性(Km)分别是PDEs[4.76+0.37uM]PDEs2[4.52±0.09uM]和PDEsA[11.39±0.22μM]。它们的cGMP结合活性(Kd)分别是PDEsa1[1.20±0.34uM]PDEsz[2.83+0.56uM和PDEsA3[2.28+0.38uM]Vardenafil对PDEs共有3个亚型抑制的半数有效率(IC50)分别是PDEA[0.41±0.15μM].PDEsa2[0.23±0.08uM]和PDEsA3[0.45±0.06μM]其效率是Sildenafil的3~12倍。

(二)PDEs蛋白三维结构的研究
PDEs由一个氨基酸端调节域和一个碳端金属离子结合水化域构成。PDEs的碳端金属离子结合水化域在PDEs的各个亚型中高度保守,也是其功能域和PDE抑制剂的结合位点。PDEs的水化域又包括多个亚功能域,包括3个发夹状亚功能域:1个N-端的折截区,1个连接区和1个C端的发夹状结构束。虽然PDEs在其水化域仅有PDE的23%的同源序列,但其拓谱构相却与PDE非常相近,其活性位点位于C端发夹束的中央,底物袋深约10Å,开口狭小而内袋宽敞,容积约330Ä3,其中包括金属结合位M点,中心Q袋,水化H袋和盖L区。而H袋和L区是PDE区别于PDE的主要点。Byung-JeSung等的研究发现,目前临床上广泛应用的3种PDE抑制剂,各有其独特的方式与PDEs结合。Tadalafil并不和PDE的L区结合,而与H袋具有相当强的结合;另一方面,Vardenafil拥有与Sildenafil非常相似的结合方式。
(三)PDEssiRNA的研究及应用
siRNA技术是近年来形成的一项新技术,并被广泛应用在基因的转录调控中,是调低阴茎中PDEs表达水平的一条提高勃起功能的分子生物学捷径。
我们"将编码一段PDEsiRNA的基因序列克隆到pSUPER载体中,并在包装细胞中形成反转录病毒。在体外,该病毒感染人类阴茎海绵体平滑肌细胞后,在细胞内表达PDEsSiRNA从而调低阴茎中的PDEs表达水平。通过RT-PCR和Western Blot证实,PDEs的表达被调低了88.2%。细胞内的cGMP水平也被明显提高,SNP刺激之后,cGMP可保持较高水平达4h。进一步的动物实验发现,PDEssiRNA可显著提高大白鼠的勃起功能
三、神经性勃起功能障碍的研究
虽然大多数勃起功能障碍可以通过口服药物得以治疗,但是神经性男性勃起功能障碍的治疗效果并不理想。导致神经性男性勃起功能障碍的因素包括全身性和局部神经损害。糖尿病是引起阴茎勃起神经损害的常见全身原因,而盆腔手术,尤其是前列腺癌根治术是导致阴茎勃起神经损害的常见局部原因。
(一)阴茎神经再生的体外研究
如何促进损伤的阴茎勃起神经恢复与再生是男科学的重要研究课题。我们利用大鼠阴茎勃起神经的盆腔大神经节(MPG),在体外构建了一个三维培养体系来研究各种生长因子对神经再生的影响。结果表明VEGFBDNFNTNT和它们的组合均能够显著促进神经纤维从MPG中再生,其中VEGF和NT的组合效果最好。通过对新生神经纤维中的TH,NOS和Ache表达的免疫组化检测发现,VEGF与BDNF可等量诱导TH和NOS神经纤维的再生,而BDNF在诱导Ache神经纤维的再生方面弱于VEGF。实际上,这个盆腔大神经节三维培养体系可用来研究其他因素对神经再生的影响,如PGE FK1706和cGMP等。

(二)阴茎神经再生的动物实验研究
多年以来,我们一直致力于寻找促进阴茎神经再生的方法,并在动物试验中取得了满意效果。神经性勃起功能障碍的动物模型是通过双侧阴茎勃起神经的钳夹或冷冻来达到局部神经损害,或通过STZ诱导糖尿病来达到全身神经损害的。将BDNF基因重组克隆到腺病毒载体中构成AAVBDNF,并将注到勃起功能障碍的大鼠阴茎中,4~8周后,勃起功能与对照相比显著改善,ICP分别为(58.5+11.7)cmHO和(613+12.5)cmH2O,而同期的对照分别为(28.4+5.5)cmH₂O和(377±7.9)cmH2O。进一步的研究表明,VEGF可以协同促进AAV-BDNF的神经恢复功能。
最新的研究发现,亲免素配体除了免疫抑制作用外,具有显著的促进神经恢复之功效。但是目前临床上常用的亲免素如FK506等对FKBP-12的结合具有非常强的免疫抑制作用,难以用于神经修复中。而另一类不具备免疫抑制作用的亲免素配体则被用于治疗神经损伤中,如GPI-1485已在临床试验治疗前列腺癌根治术所导致的阴茎勃起神经损害。我们在神经性勃起功能障碍的动物模型中试验了另一种非免疫抑制亲免素配体FK1706,结果发现,FK1706可显著改善勃起功能并有剂量依赖性。低剂量FK1706(0.1mg/kg)可提高ICP到(44.1±12.9)cmH2O;高剂量FK1706(1.0mg/kg)可提高ICP到(80.1±7.8)cmH₂o
(三)调控阴茎神经再生的细胞信号通路
目前的研究表明,4条主要的细胞信号通路参入了阴茎神经的再生,包括JAK/STAT、MAPK、IP和PLC,其中JAK/STAT最为重要。
将大鼠的双侧阴茎神经切断,在不同时间收集MPG并检测其中的JAK2,P-JAKSTATP-STATSTAT和P-STAT,结果发现JAK/STAT细胞信号通路被激活并在损伤后24h达高峰,之后逐渐回落。同时,MPG和阴茎中的BDNF表达显著提高,并有同样的时间曲线。进一步的体外实验发现,BDNF可在体外激活MPG中的JAK/STAT细胞信号通路。
四、干细胞技术与男性勃起功能障碍
众所周知,干细胞技术是近年来生物学领域的一项高新技术,在各个学科得到了广泛应用。虽然其在男性勃起功能障碍的应用和研究尚少,但也已经起步。
(一)胚胎干细胞来自胚胎内细胞团的胚胎干细胞具有多极分化性,可以分化成平滑肌细胞、内皮细胞、神经细胞等,而且可以分泌各种细胞因子。我们在体外将从胚胎内细胞团分离到的干细胞诱导分化成神经性干细胞,然后将该类细胞注射到神经性勃起功能障碍模型的大鼠阴茎和盆腔大神经节中。结果发现,阴茎中NOS源性神经纤维明显增加,勃起功能显著改善。
(二)骨髓干细胞
骨髓干细胞是来自骨髓具有多极分化潜能的一类成体干细胞,可分化成骨细胞、平滑肌细胞、心肌细胞和脂肪细胞等。骨髓干细胞在体外培养扩增后,转染AdRSVeNOS,并注射到老年大鼠阴茎中。7d后,阴茎中的NOS表达明显提高:21d后,NOS仍然维持在高水平,而且ICP明显提高,勃起功能得到改善。
(三)循环性内皮多分化细胞
最新的研究发现,机体循环系统中存在着一些内皮多分化细胞,它们可以随时到达全身内皮损伤的部位,并修复维持正常的内皮功能。在心血管疾病和男性勃起功能障碍时,循环性内皮多分化细胞显著减少。此可作为诊断勃起功能障碍的一项指标,而且也是将来干细胞治疗勃起功能障碍的一个途径。






